臨床研究法は、疾病のある方にモニターとして参加頂いたり、医薬品の成分を含むサンプルを試用して頂く場合などに適用されることが多いです。
このページでは、主に食品や化粧品の臨床試験を想定されている民間企業の方(主に以下の1や2番目の項目)を想定して臨床試験法を解説しています。
| 臨床研究の目的 | 内容 | |
|---|---|---|
| 1 | 治療法の研究 | 治療法、新薬、医療機器、手術方法などの研究探求する |
| 2 | 予防法の研究 | 薬・ワクチン・栄養・ライフスタイル等、病気の予防や再発を防ぐ |
| 3 | 診断法の研究 | 病気の診断方法を探す |
| 4 | スクリーニング研究 | 特定の病気や症状を見つける |
| 5 | QOLの向上に関する研究 | 慢性疾患を持つ患者さんのより質の高い生活を目指す |
目次
臨床研究法とは?
臨床研究を行うにあたり、不正防止のための法規制が必要になってきました。
以下の4つを目的とした『臨床研究法』が平成30年4月1日に施行されました。
1.臨床研究の質の確保
2.被験者の保護
3.資金提供・労務提供にあたっての透明性確保
4.臨床研究実施機関における利益相反の管理
その概要は、厚生労働省により、次のように発表されています。
『臨床研究の実施の手続、認定臨床研究審査委員会による審査意見業務の適切な実施のための措置、臨床研究に関する資金等の提供に関 する情報の公表の制度等を定めることにより、臨床研究の対象者をはじめとする国民の臨床研究に対する信頼の確保を図ることを通じて その実施を推進し、もって保健衛生の向上に寄与することを目的とする。』
この臨床試験法の施行により、該当する臨床試験の実施には以前よりも多くの事務手続きが必要となりました。
>どのような法規制が必要?▷臨床研究法の手続き
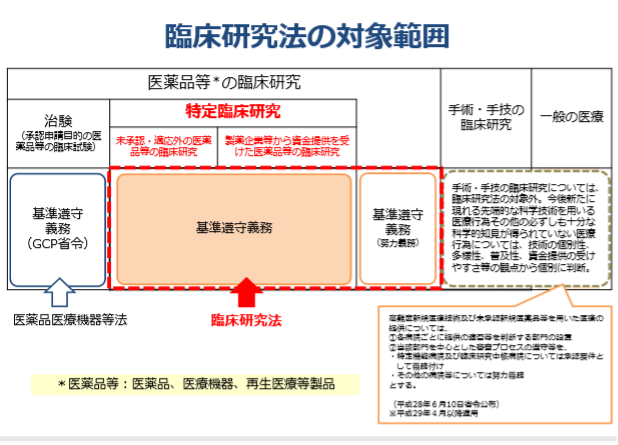
臨床研究法の適用範囲
臨床研究法が適応される範囲は、『医薬品等(医薬品、医療機器、再生医療等製品)を人に用いることにより、この医薬品等の有効性または安全性を明らかにする臨床研究のうち、承認申請目的の医薬品などの臨床試験(医薬品医療機器等法)の規定する治験やその他厚生労働省令で定めるものを除いたもの』とされています。
次の図からわかるように、主に臨床研究法の対象となる臨床研究は、製薬会社などから資金提供を受けて実施される臨床研究や未承認・保険適応外医薬品を用いた「特定臨床研究」です。
特定臨床研究とは?
治験、医薬品等の製造販売後調査(再審査、再評価、使用成績評価など)、医療機器の認証に関わる基準適合性に関する情報収集目的の試験(JIS規格のみ)や、観察研究は対象外となります。
サプリメント等は「食品」として販売されていますが、疾病の治療等が使用目的の場合は医薬品に該当し、未承認の医薬品を用いた臨床研究として臨床研究法が規定する臨床研究にあたる可能性があります。
医薬品医療機器等法第2条1項には、医薬品は、
①日本薬局方に収載されているもの
②人の疾病の診断、治療または予防に使用されることが目的とされている物
③人の身体の構造または機能に影響を及ぼすことが目的とされているもの
としています。そのため、健康の維持を目的としたサプリメントも臨床研究法の対象となるケースが考えられます。
特定臨床研究に関する公的情報
厚生労働省のホームページには、特定臨床研究の手続きに関するチェックリストが用意されています。また、臨床研究法の対象となる臨床研究と対象外となる臨床研究の事例集も公開されています。これらを参考にするとよいでしょう。
特定臨床研究の該当性に関するチェックリストhttps://www.mhlw.go.jp/content/10800000/000429043.pdf
臨牀研究法の対象となる臨床研究等の事例集について(その1)
https://www.mhlw.go.jp/content/10800000/000366416.pdf
臨牀研究法の対象となる臨床研究等の事例集等の一部改正について
https://www.mhlw.go.jp/content/10800000/000495663.pdf
臨床研究法の対象となる臨床研究等の事例集について(その1)等の改訂について
https://www.mhlw.go.jp/content/10800000/000995391.pdf
特定臨床研究の実施に際して
臨床試験の対象が、臨床研究法の適応となる場合、特定臨床研究を開始するにあたり、多くの手続きが必要となります。詳しくは、上記の通り特定臨床研究開始時手続きに関するチェックリストが公開されていますので、そちらを参考に漏れの無いように書類を準備するとよいでしょう。
後述の臨床研究法の手続きでも解説していますので参考にされてください。
臨床試験の透明性の確保:利益相反管理
臨床研究法での利益相反管理の目的は、医薬品等製造販売業者等の関与の状況を適正に管理し、透明性を高め、臨床研究に対する信頼の確保を図ることで、適切な臨床研究を推進することです。
そのために、所定の様式で利益相反に関する報告が必須です。
必要となる書類は最少で6つ(様式A~Eおよび統一書式1)ですが、だれが作成すべき書類なのか留意が必要です。また、作成した文書は、研究責任者が5年間の保存することが求められます(臨床研究施行規則第53条第2項第1号・7号)
利益相反申告が必要な者とされるのは、研究責任者、研究分担者、統計解析責任者、当該研究に関する特許保有者、公的資金獲得者などの当該臨床研究実施により利益を得ることが明白な者とされています。
また、次に該当する場合は、本人及び生計を共にする配偶者、一親等親族の前年度と当該年度の申告が必要となります:
①1社からの年間200万円以上の寄付金
②寄付講座所属
③1社からの個人的利益が年間100万円以上
④役員等への就任
⑤株式の保有や出資
⑥その他(寄付講座の受け入れ、特許権の保有等)
様式内の「企業等」は、国内外問わず、会社法で規定さ規定された法人組織の医薬品製造販売業者またはその特殊関係者(医薬品等製造販売者の子会社等)です。非営利団体は、「企業等」に含まれませんが、その団体の運営資金が特定の企業から提供する場合は、その特定の企業が「企業等」に含まれます。医薬品開発業務受託機関などは「企業等」に含まれません。「研究費等」は臨床研究、共同研究、受託研究、および学術指導に対する資金提供や研究助成金などを指し、人件費を受け入れる場合も対象となります。金額基準はないので、全ての「研究費等」を様式に記載することが求められます。
医学系研究では、所属機関の利益相反管理の方針に従いますが、臨床研究法に基づく利益相反管理では、研究責任者が利益相反管理基準、利益相反管理計画を策定・管理する点が異なります。
被験者の保護と臨床研究の質の確保
臨床研究法では、研究責任者が特定臨床研究を実施するにあたり、
①適切なインフォームド・コンセントの取得
②記録の作成・保存
③研究対象者の秘密の保持
④臨床研究実施基準を遵守すること
を義務付けています。
臨床試験が正しく行われているか「モニタリング」し、結果が出てから研究が研究計画通り実施されたかを「監査」するために、臨床研究法では研究計画書のほかに、「モニタリングに関する手順書」、「監査に関する手順書(任意)」などの認定臨床研究審査委員会へ提出が求められます。また、上記のほかに、補償の概要を含んだ「説明文書」、「同意文書」、「疾病等が発生した場合の対応に関する手順書」、「統計解析計画書(任意)」、「医薬品等の概要を記載した書類(任意)」なども認定臨床研究審査委員会へ提出し意見を聞くことが求められ、被験者の保護と臨床研究の質の確保を図っています。
臨床研究法の手続き
平成30年4月1日に臨床研究法が施行されました。臨床研究法の施行により、臨床研究の実施には以前よりも多くの事務手続きが必用となることとなりました。信頼性の高い、質の高い臨床研究の実現のための法規制ですので、どのような手続きが必要か見ていきましょう。
臨床研究法の適応範囲
臨床研究法で臨床研究法の適応範囲について説明しました。チェックリストや事例集を参考にしてください。判断が難しい場合は、各都道府県の薬務担当課に相談の上、試験の対象が臨床研究法の適応範囲にある場合は、臨床研究法に沿った準備が必要です。
特定臨床研究開始の手続き
臨床試験の対象が、臨床研究法の適応となる場合、特定臨床研究を開始するにあたり、多くの手続きが必要となります。詳しくは、厚生労働省が、特定臨床研究開始時手続きに関するチェックリストを公開していますので、そちらを参考に漏れの無いように書類を準備するとよいでしょう。
JRCTへの登録
臨床研究実施計画・研究概要公開システム(JRCT)は、認定臨床研究審査委員会申請・情報公開システムです。臨床研究法に基づき、認定の申請や変更などの手続きをこちらで行います。臨床研究の透明性の確保のため、情報は公開されます。当該臨床研究はこのJRCTへの登録が義務付けられています。
特定臨床研究を開始するには、まず、JRCTに新規登録し、臨床研究計画情報を一時保存します。
この時、以下の項は空欄のまま一時保存します。
①当該特定臨床研究に対する管理者の許可の有無
②認定臨床研究審査委員会の承認日
③当該臨床研究に対する審査結果
④研究資金等の提供の有無は、予定で記載する(契約前のため)
⑤審査受付番号(認定臨床研究審査委員会が当該研究に発行した受付番号がある場合)
臨床研究実施計画・研究概要公開システム(JRCT)
https://jrct.niph.go.jp/
利益相反に関する書類の作成
研究代表者は実施しようとする臨床試験に関する【利益相反管理基準(様式A)】と【関係企業等報告書(様式B)】を作成します。
次に、研究責任者と研究分担者等が、【利益相反管理基準(様式A)】と【関係企業等報告書(様式B)】をもとに【研究者利益相反自己申告書(様式C)】を作成し、所属機関へ【研究者利益相反自己申告書(様式C)】を提出します。
所属機関は、全ての【研究者利益相反自己申告書(様式C)】の事実確認を行い、【利益相反状況確認報告書(様式D)】を作成します。研究責任者は所属する機関の全研究分担者と自身について、【利益相反状況確認報告書(様式D)】をふまえ、研究責任者が【利益相反管理基準(様式A)】に基づき【利益相反管理計画(様式E)】を作成します。
単施設試験の場合は研究責任者が代表となりますが、多施設共同試験は、研究全体の研究代表者のほかに各実施医療機関に研究責任者がいますので、【利益相反管理基準(様式A)】は、研究代表者が1つの研究計画書につき1つ、各実施医療機関の研究責任者がそれぞれ【利益相反管理計画(様式E)】を作成します。 また、【研究分担者リスト(統一書式1)】もこのステップで作成します。

