UMIN登録のページでも説明しました通り、正式に臨床試験が登録されると、取り下げはできません。
登録後の修正は履歴がすべて残るので、登録の前に入念なチェックが必要です。
本ページでは、Wordファイルを使用したUMIN登録の事前準備についてUMIN臨床試験登録システムのHPで詳しく説明されているものを、簡易的に下記に記して説明いたします。
※実際のUMIN登録には、UMIN IDとパスワードが必要です。
目次
- 1 UMIN-CTR登録用フォーム
- 1.1 基本情報/Basic infomtion
- 1.2 対象疾患/Condition
- 1.3 目的/Objectives
- 1.4 評価/Assessment
- 1.5 基本事項/Base
- 1.6 試験デザイン/Study design
- 1.7 介入/Intervention
- 1.8 適格性/Eligibility
- 1.9 責任研究者/Principal investigator
- 1.10 試験問い合わせ窓口/Public contact
- 1.11 情報送信組織/Organization sending information
- 1.12 試験実施責任組織/Sponsor
- 1.13 研究費提供組織/Funding Source
- 1.14 その他の関連組織/Other related organizations
- 1.15 IRB等連絡先/IRB Contact
- 1.16 他機関から発行された試験ID
- 1.17 試験実施施設/Institutions
- 1.18 その他の管理情報/Other administrative information
- 1.19 関連情報/Related information
- 1.20 結果/Result
- 1.21 試験進捗状況/Progress
- 1.22 その他/Other
UMIN-CTR登録用フォーム
正式に臨床試験を登録する前に、準備作業用のWordファイルを使い下書きを行います。
また、日本語だけでなく英語による入力も必須ですので必ず入力してください。
必須入力と任意入力の項目があるので以下のように示します。
必須入力:赤マーカー
任意入力(他のデータ内容により入力が必要になる項目):黄色マーカー
基本情報/Basic infomtion
【一般向け試験名】
専門用語はなるべく使わず、一般の方にも容易に理解できるような表現とした試験の題名とします。
【一般向け試験名略称】
一般向け試験名の略称。
【科学的試験名】
正式な試験の題名。
通常は〈介入の名称〉、〈対象疾患〉、〈アウトカム〉、〈試験デザイン〉に関する記述が含まれます。
すでに倫理委員会で承認を得ていたり、その他外的な申請に用いた試験名がある場合はその試験名を正式なものとして、この欄に記入します。
例)〇〇含有サプリメントの摂取が健常高齢者の口腔内環境に及ぼす効果の検証:ランダム化プラセボ対照二重盲検並行群間比較試験
【科学的試験名略称】
科学的試験名の略称。
例)〇〇含有サプリメント摂取口腔効果試験 など
【試験実施地域】
試験を実施した地域を選択します。
複数選択可能で、実施地域により試験登録のための言語が異なり、入力画面も異なるため入力画面の制御のために必要です。
日本が実施地域に含まれる場合は、日本語と英語での登録が必要になります。(日本が実施地域に含まれない場合は、英語の入力欄のみになる。)
対象疾患/Condition
【対象疾患名】
研究の対象とする疾患名、病態や状態。
健康な人に参加してもらう試験の場合、最終的にどのような疾患を持つ人や状態の人に適用を期待しているのかに基づいて記載します。
※当該試験で組み入れる、参加者の状態を記載するものではありあません。
健康食品を評価する臨床試験は、最終的に健康な人への適用を期待しているので「健常成人」や「健常高齢者」などになります。
※ここで上記のような記載にする場合は、【選択基準】に『健康な〇〇(成人)』等を含めて記載する必要があります。
【疾患区分1】
対象疾患の診療領域を選択します。(複数選択可)
試験を行う予定の診療科をもとに選択します。
健康食品を評価する臨床試験は「該当せず」を選択します。
また、健常人の欄では「成人」を選択します。
【疾患区分2】
対象疾患が悪性腫瘍であるか、またはがん悪性腫瘍以外の疾患であるか選択します。
【ゲノム情報の取扱い】
試験参加者のゲノム情報を入手または解析し、結果との関連性の考慮などに用いるか否かを「はい/いいえ」で選択します。
目的/Objectives
【目的1】※記述記載
試験を実施する目的を記述記載します。
例)試験食品の摂取が健常高齢者の口腔環境に与える効果を検討する
【目的2】
主要アウトカム評価項目により評価する最も基本的事項。
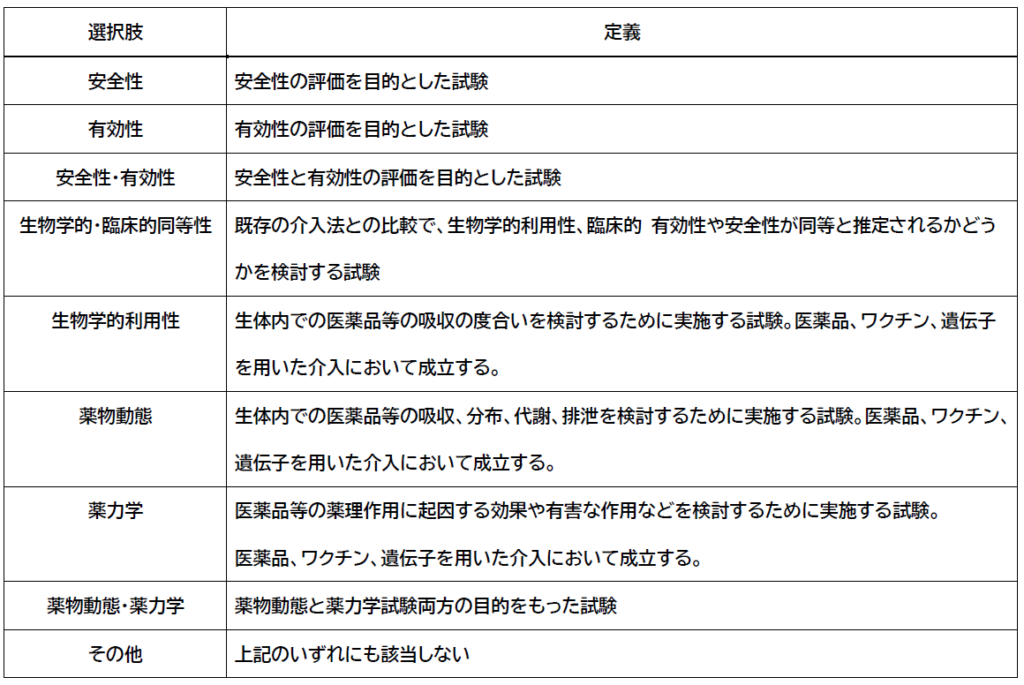
【その他の場合の詳細】
目的2がその他の場合、詳細の記載が必要になります。
【試験の性質1】
仮説の検証を目的とした試験か否か選択します。

【試験の性質2】
試験の目的と実施状況に基づく分類を選択します。

【試験のフェーズ】
医薬品あるいは治療法を開発する試験の場合、その開発段階を選択します。

評価/Assessment
【主要アウトカム評価項目】※記述記載
評価に用いる最も主要な指標を記述で記載ます。
原則として、最も主要な評価項目1つのみを記入し、他の評価項目は「副次アウトカム評価項目」としてください。
また、可能な限り評価の時期の情報も含めて記載します。(投与開始から4週間後など)単に「安全性」「有効性」などと記入するのではなく、どのような測定によって安全性や有効性を評価しようとするのかを記入してください。
【副次アウトカム評価項目】※記述記載
評価に用いる具体的で副次的な指標を記述で記載します。
こちらも可能な限り評価の時期の情報も含めて記載します。
必須入力ではないですが、基本的に入力することをお勧めします。
基本事項/Base
【試験の種類】
介入的試験か、観察的試験か選択します。

試験デザイン/Study design
以下は介入試験の場合に必要です。観察研究では記入せず、「その他の関連情報」の欄に自由文で詳細な情報を記入してください。
【基本デザイン】
最も基本的な試験デザインを選択します。

【ランダム化】
試験参加者に割り当てられる群が確率的要素により決定する、ランダム化割り付けを行うか否か選択します。
「準ランダム化」試験も「ランダム化」試験としてください。
「単群」で行う試験の場合は、「非ランダム化」試験としてください。

【ランダム化の単位】
どのような単位でランダム化を行い、割り付けるかを選択します。
個々の参加者単位で各群に割り付けるか、ある特性をもった集団単位で割り付けるか。
※「ランダム化」試験の場合は、必ず記載してください。
「非ランダム化」試験の場合は、記載は不要です。

【ブラインド化】
試験参加者、介入実施者および測定者が、試験参加者の割り付けられている群を知りえているか否か選択します。
単群試験では「オープン」を選択してください。

【コントロール】
比較対照の種類を選択します。
単群試験では、「ヒストリカル」or「無対象」or「群内」を選択してください。

【層別化】
予後因子となりえる施設以外の背景因子を層別化し、1つの層の中で群の例数の分布が均等になるように割り付ける方法を採用しているか否かを選択してください。
「ランダム化」試験の場合は、可能な限り記載してください。
「非ランダム化」試験の場合は、記載は不要です。
【動的割付】
新しい試験参加者を割り付ける際に、それまでに割付けられた群間の背景要因のバランスを反映させて、逐次、割付けられる群が決定される方法を採用しているか否か選択します。
「ランダム化」試験の場合は、可能な限り記載します。
「非ランダム化」試験の場合は、記載は不要です。
【試験実施施設の考慮】
割付において試験実施施設をどのように考慮しているかを選択します。
「ランダム化」試験の場合は、可能な限り記載します。
「非ランダム化」試験の場合は、記載は不要です。

【ブロック化】
ある人数の「ブロック」を設定し、1つの「ブロック」の中で群の例数の分布が均等になるように割付ける方法を採用しているか否か選択します。
「ランダム化」試験の場合は、可能な限り記載します。
「非ランダム化」試験の場合は、記載は不要です。
【割付コードを知る方法】
割付コードを作成し、管理する方法として、どのような方法を採用しているか。介入実施者が割付結果を予見できるか否かの指標を選択します。
「ランダム化」試験の場合は、可能な限り記載します。
「非ランダム化」試験の場合は、記載は不要です。

介入/Intervention
以下の「介入」は、介入を伴う臨床試験に関する情報についてです。観察研究では入力しないでください。
【群数】
対照群も含めた群の数を記載してください。
例)プラセボ対照試験の場合、試験品群とプラセボ群の2群になります。
【介入の目的】
介入の目的を選択してください。

【介入の種類】
介入の種類を選択してください。

【介入1】※記述記載
介入群または対照群の内容の詳細を記述にて記載します。
「群数」に記載した数の内容の記載が必要です。
2群の場合、「介入1」と「介入2」にそれぞれ記載します。
以下の点を参考に、可能な限り詳しく記載してください。
・個々の被験者に対する介入期間
・量(投薬量・線量など)
・回数、頻度など
※特に長期にわたる投薬や機器使用の介入の場合、具体的な期間を必ず含めて下さい。
例)介入1:試験品サプリメントを1錠/日、4週間摂取
介入2:プラセボを1錠/日、4週間摂取
適格性/Eligibility
【年齢(下限)】
参加者として適格とする年齢の下限を記載します。
下限がない場合は、数値は空欄とし、年齢(下限)単位の入力欄に「適用なし」を入力してください。
例)20歳以上の場合
20歳/years-old 以上/<=
【年齢(上限)】
参加者として適格とする年齢の上限を記載します。
上限がない場合は、数値は空欄とし、年齢(上限)単位の入力欄に「適用なし」を入力してください。
例)75歳未満
75歳years-old 未満/>
【性別】
参加者として適格とする性別を選択します。
【選択基準】※記述記載
参加者として適格とする主な基準を記載します。
(被験者募集の際に選択基準として設定したものを記載する。)
例)(1)一般的に健康であるとみなされる者
(2) 文書による自発的な試験参加の同意が得られる者
(3)年齢が40歳以上の者 など
【除外基準】※記述記載
参加者として不適格であるとする主な基準を記載します。
(被験者募集の際に除外基準として設定したものを記載する。)
例)(1)本試験で検討する有効性と同様もしくは、関連する効果・効能を標榜あるいは強調した
健康食品、医薬部外品あるいは医薬品を継続的に摂取している
(2)過去4週間以内に、健康食品を変更、あるいは新たに使用開始した
(3)夜勤および昼夜交代制勤務をしている など
【目標参加者数】※記述記載
本試験に組み入れる予定の参加者数を記載します。
責任研究者/Principal investigator
これより先はほとんどの項目が記述記載です。
【責任研究者名】
本試験の科学的側面に対して責任を有する方の氏名を記載します。
【所属組織】
本試験の科学的側面に対して責任を有する研究者の所属組織
【所属部署】
本試験の科学的側面に対して責任を有する研究者の所属部署名
【住所】
本試験の科学的側面に対して責任を有する研究者の所属組織の住所
【電話】
本試験の科学的側面に対して責任を有する研究者の所属組織の電話番号
【E-mail】
本試験の科学的側面に対して責任を有する研究者の所属組織の電子メースアドレス
試験問い合わせ窓口/Public contact
【担当者】
本試験情報が公開された場合、一般からの問い合わせ窓口となる組織の担当者の方の氏名
【組織名】
本試験情報が公開された場合、一般からの問い合わせ窓口となる組織の名称
【部署名】
本試験情報が公開された場合、一般からの問い合わせ窓口となる組織の部署名
【住所】
本試験情報が公開された場合、一般からの問い合わせ窓口となる部署の住所
【電話】
本試験情報が公開された場合、一般からの問い合わせ窓口となる部署の電話番号
【試験のホームページURL】
本試験情報が公開された場合、試験に関する情報を提供できるURL
【E-mail】
本試験情報が公開された場合、一般からの問い合わせ窓口となる電子メールアドレス
情報送信組織/Organization sending information
【送信者名】
本試験情報を送信した方の氏名
情報送信組織とは、試験情報を実際に登録する組織を設定するように想定しています。
たとえば、臨床試験実施責任組織、責任研究者、委託先(公益法人、企業、等)を設定できます。
UMINセンターから連絡を取る可能性がありますので、確実に連絡をとれるように 記入をします。
【情報送信組織】
本試験情報を送信した方の所属組織名
【所属部署】
本試験情報を送信した方の所属部署
【住所】
本試験情報を送信した方の所属組織の住所
【電話】
本試験情報を送信した方の所属組織の電話番号
【E-mail】
本試験情報を送信した方の電子メールアドレス
試験実施責任組織/Sponsor
【実施責任組織】
試験の計画、解析と結果公表、研究費調達を含めた実施のための 運営管理に対して責任を持つ組織
※研究費提供の概念とは別です。
どの臨床試験においても「なし」はあり得ません。
研究費提供組織/Funding Source
【研究費提供組織】
研究費を支給している、最も主要な組織(1組織)を記載します。
支給の形態は契約、助成、寄付などを問いません。
また、試験の説明会等の会場費負担・交通費支給、症例登録施設への研究協力費支払や 金銭に限らず現物提供 等を行っている組織も相当します。
どこからも助成をうけないで実施する臨床試験では組織区分を「自己調達」とし、研究費提供組織の欄は、「なし」「None」としてください。
【組織の区分】
研究費提供組織の区分を選択します。
【研究費拠出国】
研究費を提供している組織の存在している国
【共同実施組織】
試験実施責任組織と研究費提供組織以外の組織で、共同研究などで試験の実施に 関係している組織。
なければ記載は不要です。
【その他の研究費提供組織】
試験実施責任組織と研究費提供組織以外の組織で、研究費、被験薬などの 試験関連資材等を提供している組織。複数ある場合は、箇条書きにしてください。
なければ記載は不要です。
IRB等連絡先/IRB Contact
IRB(Institutional Review Board)は倫理審査委員会のことです。
【倫理委員会による審査・承認】
臨床試験の実施について倫理委員会からの承認の有無を明記します。
【日本の法規に定める医薬品製造業者等による医薬品の市販後調査への該当】
医薬品製造業者等でない場合は、「該当なし」を選択します。
【組織名】
公開用の、主要なIRBの設置されている組織名。
【住所】
試験進捗などをUMINセンターから問い合わせる際の、主要なIRBの設置されて いる組織の住所
【電話】
試験進捗などをUMINセンターから問い合わせる際の、主要なIRBの電話
【E-mail】
試験進捗などをUMINセンターから問い合わせる際の、主要なIRBに連絡をとることができる電子メールアドレス
他機関から発行された試験ID
【他機関から発行された試験ID】
他の登録機関に試験を登録し、IDの発行を受けているか否かを選択します。
【試験ID】
他の登録機関からIDを発行されている場合のID。
【ID発行機関】
他の機関からIDを発行されている場合のID発行機関。
【治験届初回届】
日本で実施しており、日本の厚生労働省に「治験届」を提出している場合の、初回届出年月日と届出回数
試験実施施設/Institutions
【試験実施施設名称】
本試験を実施する予定施設名称と所在都道府県
例)○○大学病院(東京都)、△△病院(愛知県)、××医院(大阪府)
その他の管理情報/Other administrative information
【試験情報の本登録希望日(=公開日)】
登録した臨床試験の存在および情報を一般に公開する日付
試験の結果を含めた”すべての情報”を公開する希望日ではありません。
UMIN-CTRでは、まず試験の存在を公開し、この時点の情報をベースに、情報の変更、試験進捗の推移や結果を反映していくことを想定しています。
これから実施する試験の場合、登録作業の当日や、参加者の登録・組み入れ開始 予定日、すでに開始したり終了したりしている試験の場合、登録作業の当日を 設定するのが一般的です。
必ず、登録作業の当日かそれ以降の日付である必要があります。
また、本登録希望日(=公開日)に達した日付以降(試験が公開された場合)、本登録希望日は変更できません。
関連情報/Related information
【プロトコル掲載URL】
プロトコルが一般に公開され、閲覧できるURL。
【試験結果の公開状況】
本試験の結果の公開状況
結果/Result
【結果掲載URL】
本サイトへの試験結果記載とは別に、結果が一般に公開され、閲覧できるURL。
【組み入れ参加者】
本試験に組み入れた参加者の人数
【主な結果】
主要な結果の記述
フォロー終了(予定)日から12ヶ月目以降に更新を行う場合、この項目の記載が必須となります。
【主な結果入力日】
結果を入力した日付
【結果掲載遅延・遅延理由】
フォロー終了(予定)日から12ヶ月を経過しているが、試験結果を掲載できる状況でない場合、こちらにチェックをして理由を記載してください。
【最初の試験結果の出版】
試験結果が学術誌に最初に出版された日付
【参加者背景】
被験者全体、および群ごとの参加者背景。
年齢、性別など被験者背景の分布を全体および群ごとに記載してください。
【参加者の流れ】
ランダム割付けされた人数、ランダム化後の除外人数、各群の追跡人数と追跡不能人数、各群で意図された治療を受けた人数、 主要アウトカムの解析に用いられた人数などを記載。
【有害事象】
研究期間中もしくは研究終了後一定期間内に観測された、被験者に起こった望ましくない変化を記載。
【評価項目】
主要評価項目および副次評価項目のすべてについて、群ごとに、精度(例えば95%信頼区間)とともに値を記載。 適切な統計解析の結果があればそれも記載。
【個別症例データ共有計画】
匿名化された個別症例データの共有を行う計画の有無を記載。
【個別症例データ共有計画の詳細】
匿名化された個別症例データの共有計画の詳細を記載。
試験進捗状況/Progress
【試験進捗状況】
参加者登録や試験の進行状況を選択します。
【プロトコル確定日】
プロトコルが確定した日付を記載します。
【登録・組み入れ開始(予定)日】
最初の参加者の登録・組み入れ開始予定日。最初の参加者が登録 された後は、実際に最初の組み入れが行われた日付。
【フォロー終了(予定)日】
最後の参加者の最終観察予定日。最後の参加者の観察が終了した後は、実際に観察が終了した日付。
【入力終了(予定)日】
試験データの入力終了予定日。データ入力が終了した後は、実際に最後の入力が実施された日付。
試験の登録時は空欄でもかまいませんが、試験の進捗状況が「試験中止」「試験終了」 になった段階では記載が必要です。
【試験終了データ固定(予定)日】
試験データの固定予定日。データが確定した後は、実際にデータが確定した日付。
試験の登録時は空欄でもかまいませんが、試験の進捗状況が「試験中止」「試験終了」 になった段階では記載が必要です。
【解析終了(予定)日】
解析が終了し、結論を得る予定日。解析が終了した後は、実際に解析が終了した日付。
試験の登録時は空欄でもかまいませんが、試験の進捗状況が「試験中止」「試験終了」 になった段階では記載が必要です。
その他/Other
【その他の関連情報】
関連する情報を自由に記載できる欄。
(参考文献)
UMIN臨床試験登録システム(UMIN-CTR)
https://www.umin.ac.jp/ctr/UMIN-CTR_Yougo.htm#


