本ページでは、臨床試験の最終段階において最重要となる最終報告書作成について、ご説明いたします。
ページの最後に最終報告書の例としてWordファイルを添付しておりますので、よろしければそちらも合わせてご参照ください。
最終報告書の内容
最終報告書作成までの流れは以下の通りです。
①試験終了後、データの入力(解析)
〔参考ページ:結果入力、一覧表の作成〕
②チャンピオンデータを用いた速報の作成(グラフ、パワーポイント)
〔参考ページ:速報のグラフ、パワーポイント〕
③最終報告書作成
報告書の項目は以下のように分け、項目ごとに記載します。
Ⅰ.本試験の要約
Ⅱ.試験の目的
Ⅲ.実施組織
Ⅳ.倫理的事項
Ⅴ.試験方法
Ⅵ.試験結果
Ⅶ.考察
報告書を作成するにあたり、以下のことは全ページで統一します。
・報告書全体のフォントを揃える。(数字についても全角・半角いずれかに揃える)
・レイアウトの余白(「やや狭い」が望ましい。)
・語尾は「~した。」という風に常態を用いて作成する。
これより、項目ごとに詳しい記載内容や注意点について説明します。
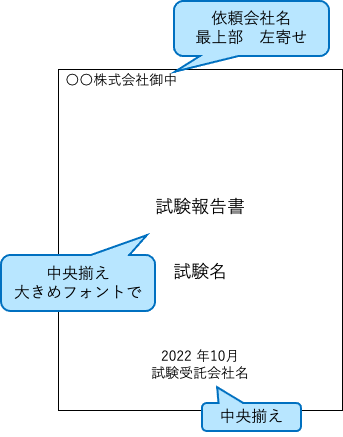
表紙
・報告書の表紙に書く項目
- 依頼会社名
- 題目「試験報告書」「試験名」
- 提出日
- 試験受託会社名
全体のフォントは14ptぐらいで見やすいように設定します。
2.題目はフォントを他よりも大きめにします。(18ptぐらい)
目次
試験内容により、必要項目は多少異なりますが下記の目次はほとんどの場合フォーマットとして使用できます。


・見やすいように太文字にしたり、文字のポイント数を変えたりします。
例)Ⅰ~Ⅶ:12pt、1~8:11pt、3-1など:10pt(太文字にしない)
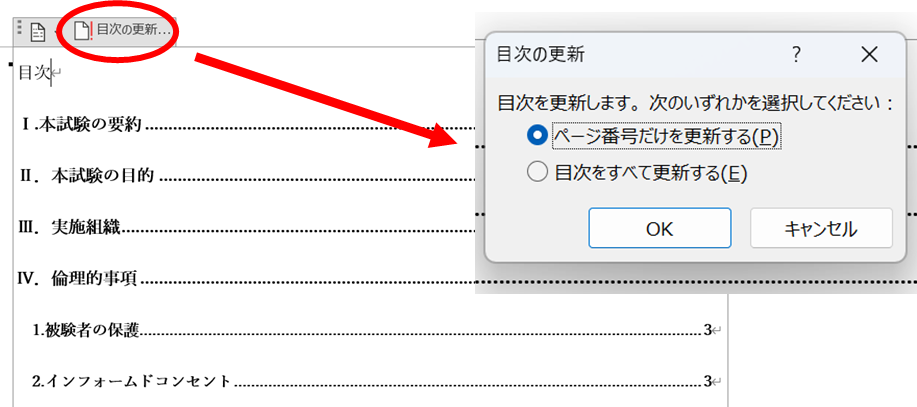
・フッター(ページ下中央)にページ番号を挿入し、目次にページ番号が表示されるようにします。
・目次は報告書作成の最後に確認し、ページ番号の更新を行います。
・Wordでの目次の作成は下記サイトが参考になります。
Wordでの目次の作り方!追加、更新、編集方法[ワード(Word)の使い方]All About
https://allabout.co.jp/gm/gc/474750/
本試験の要約
試験全体の流れを短くまとめて記載します。
- 試験の目的
- 試験における被験者の条件・区分・背景(年齢や性別)
- 試験期間(20xx年◎月△日~●月◇日)
- 摂取量、摂取期間、測定回数(摂取前とどの時点のを比較したのかわかるように記載)
- 試験方法、評価項目(例:血液検査、尿検査、質問紙など)
- 簡易的な結果および考察(有意な差が見られた項目を示し、その上でどのようなことが示唆されたかを記述)
【例】

※報告書に必須ではないが論文化の際に記載が必要なもの
・詳細な試験期間
・倫理審査委員会にて認証を得た際の承認番号
※UMIN-CTRの登録について
・機能性表示を目的とした試験では、登録が必要になります。
・登録した際は、報告書に登録番号を記載します。
例)本試験は、UMIN-CTRに登録した(登録番号:UMIN0000xxxxx)
試験の目的
本試験を実施するにあたり何を目的としたのかを明確簡潔に記載します。
実施組織
試験に携わった組織名をすべて記載します。
2、3はその所在地も含めて記載します。
1.試験委託者(クライアント社名)、2.試験受託者、3.試験実施施設
倫理的事項
法律に違反しないこと、基準に準じていることをあらわすために『倫理的事項』の記載が必須となります。
実際にヒトによる臨床試験を行う際には以下の項目を実施したうえで記載します。
1.被験者の保護
本試験はヘルシンキ宣言(2013年フォルタレザ修正)、人を対象とする医学系研究に関する倫理指針(平成26年文部科学省・厚生労働省告示第3号)を遵守して実施した。
2.インフォームド・コンセント
試験担当者は、被験者が試験に参加する前に、本試験の目的や内容などについて十分に説明を行い、被験者が内容を十分に理解し、納得したことを確認の上で、本試験への参加について自由意志による同意を文書で取得した。


