試験方法
試験方法には試験の種類、試験品の説明、試験に使用する機器など全内容を細かく記載します。
1.試験デザイン
例)プラセボ対照二重盲検並行群間比較試験、過剰摂取安全性試験(〇日間)
2.試験品およびプラセボ
・試験品:クライアント様よりご提示いただいたように記載
・プラセボ:プラセボとして何を用いたか記載(※)
・提供者:クライアント様社名
※以下はプラセボの説明であり、記載することが望ましいです。
(被験者用説明書に記載するものと同様です。)

3.対象被験者の適格性
・被験者の条件として設定した選択基準、除外基準を記載します。
1)選択基準
被験者募集における条件
例)年齢が18歳以上60歳未満の男女
一般的に健康であるとみなされる者 など
2)除外基準
被験者募集における除外基準
4.評価項目
試験に使用したすべての評価項目を記載します。
5.割付方法
・被験者を群分けする際の条件や人数の割合(どのような方法で割付けを行ったのか記載)
・群分けの年齢やBMIなどの平均値を記載
・安全性評価の試験など、場合によっては記載の必要がないときもある
(割付けの必要がない試験)
例)

6.介入
試験品の摂取・使用量、摂取期間を記載します。
例)試験品またはプラセボを1日〇㎎、△週間(✖日間)摂取した。
7.観察・検査方法
1)試験スケジュール
事前測定や事後測定などの実施日程、測定時間の記載
※飲用記録用紙がある際は記載する(いつ記入させ、いつ回収したか)
【例1】

2)実施内容(実施手順)
事前測定・事後測定ごとに測定実施内容を測定項目を含めすべて記載します。
【例1】

【例2】

3)検査内容
検査項目ごとに質問紙の内容や測定条件、使用機器(機器の製造社名)などを記載します。
参考文献がある場合は項目ごとに記載します。
【例1】


【例2】

8.有害事象の判定(または、その他の事象)
試験品を摂取・使用したことにより新たに発現したものを有害事象とし、その有無について記載します。その他の事象がある場合も記載します。
9.統計学的事項
各評価項目に対して使用した統計学の分析方法を記載します。
試験結果
上記に記した『観察・検査方法』の[7-3.検査内容]に記載した項目すべてにおいて表・グラフを用い、結果を記載します。
1.解析対象者
・組み入れた被験者のうち、実際に解析対象となった人数を記載します。
(各群の年齢やBMIなどの平均値も記載)
【例】

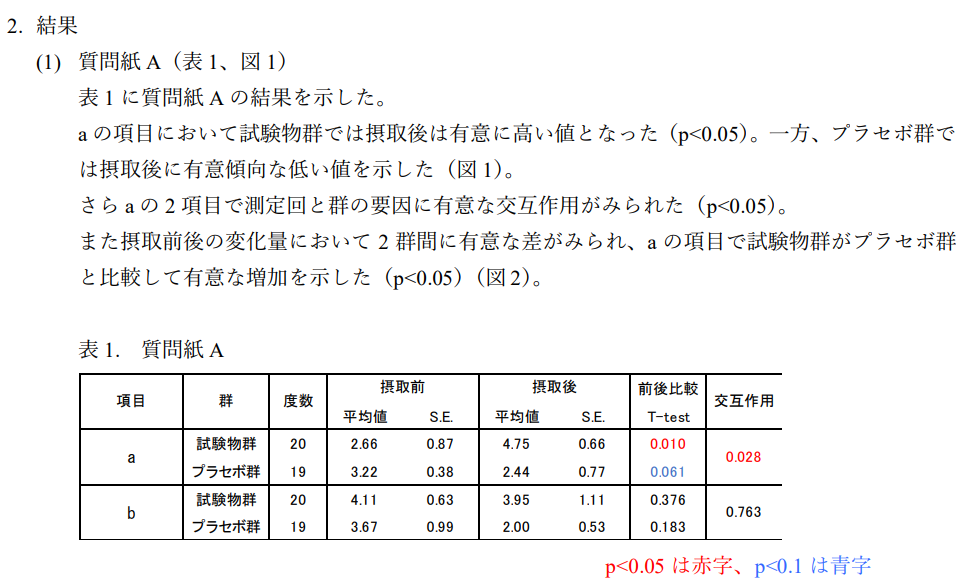
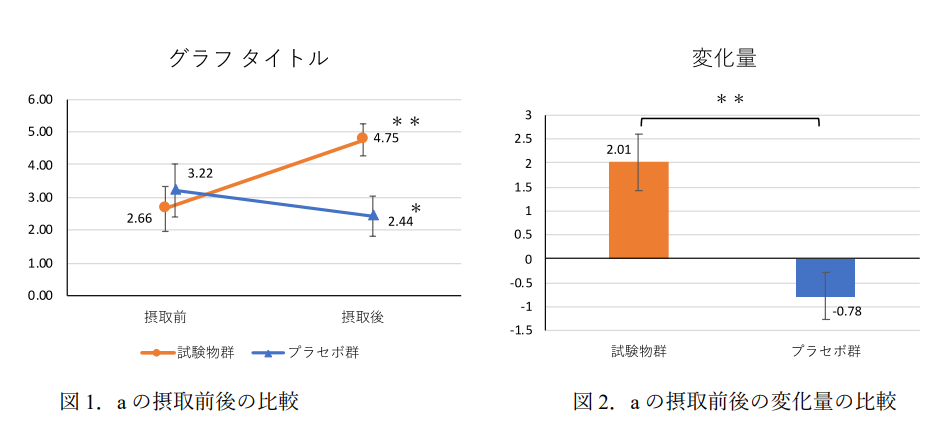
2.結果
・『Ⅴ.試験方法』の[7-3.検査内容]に記載した項目すべてにおいて表・グラフを用いて結果を
記載します。
・試験結果に合わせて適切なグラフを示します。表・グラフは本文中で引用して説明します。
・結果に対してどの表やグラフが対応しているかわかるように記載します。(例を参照)
・速報の際に制作したグラフでは、「エラーバーは標準誤差を示す」や「sv事前」はグラフ内に
示しましたが報告書では本文中に記載しますので、グラフからは削除します。
・表:表番号・題目を表の上に記載。有効数字・単位に注意
・図:図番号・題目を図の下に記載。有効数字・単位に注意
・表、グラフの作成はこちらをご参照ください。
【例】
考察
試験結果を用いて有意差などから分析し、考察を記載します。
考察は感想を述べるのではなく、結果から客観的に判断できることを記載します。
今後の試験にもつながるので、示唆される内容を熟考して考察を記載します。
以上が、最終報告書作成のマニュアルとなります。
臨床試験中は勿論、最終報告書の作成まで気を抜かないように心掛けましょう。
最終報告書の例(Wordファイル)
評価対象別でテンプレートを作成しました。
下記報告書のテンプレートは赤字部分を実際の試験の内容に書き換えていただくと、ほとんど完成に近い状態になります(赤字以外の部分も必要に応じて書き換えてください)。
結果(表・グラフ)や考察は例として記載していますので、実際の試験の内容をもとに結果や考察を記載してください。
①メタボリックシンドローム試験の報告書テンプレート
②メンタルヘルス試験の報告書テンプレート


